type
status
date
slug
summary
tags
category
icon
password
网址
2024年5月3日——《Cosmetics》(MDPI)发表的一项前瞻性、评估者盲法队列研究提示:单次单极射频治疗后,下颌缘松弛与法令纹改善在第12周达到显著水平,并可维持至第24周;同时,面颊皮肤紧实度在第4周即出现客观提升,并在随访期内持续改善。
在抗衰领域,“紧致”之所以值得被反复讨论,是因为它不仅关乎一时的视觉变化,更关乎皮肤结构层面是否发生了可延续的重塑。而这项研究之所以具有参考价值,在于它不仅看照片,更同时引入了盲评医生评分 + 仪器化客观测量,让“改善”具备更明确的证据表达。
研究怎么做:盲评医生 + 设备测量,跟踪24周
研究纳入20名42–60岁女性(Fitzpatrick III–IV型,轻-中度面部松弛),接受单次单极射频治疗;治疗后在第4、12、24周进行标准化随访拍照,并由3名未参与治疗的皮肤科医生(盲法)基于照片对皮肤松弛改善进行分级。同时,研究使用皮肤测试设备对面颊紧实度等指标进行测量,以观察更客观的结构变化。
研究看到了什么:轮廓更清晰,紧实度“可测量地”变好
研究结果显示:
- 盲评改善:下颌缘与法令纹在12周出现统计学显著改善,并维持到24周。
- 客观指标:面颊紧实度在4周即显著上升,并在12与24周继续改善,研究将其与胶原重塑与真皮结构变化相关联。
- 安全性:研究随访中未观察到灼伤、破损或瘢痕等不良事件,且治疗过程中未报告疼痛。
这意味着:单次治疗不仅可能带来“当下的收紧感”,更可能触发一个在数月内持续推进的结构性改善窗口。
把研究放进真实临床:为什么这与肤动能™的“抗衰体验”高度同向
肤动能™FP01定位为“新一代无痛长效类单极射频”,其核心思路与研究中的单极射频路径一致:让高频电流进入皮下组织产生热能,在表皮保护下作用于真皮胶原纤维,使其出现受热瞬时收缩,并进一步刺激胶原再生与重新排列,从而推动紧致与淡纹等表现改善。
不同之处在于,肤动能™更强调把“有效”与“舒适”同时做到可交付:
- 通过智能恒温水冷把表皮温度稳定控制在特定区间,用更可控的方式降低不适与风险;
- 结合平波脉冲与深层高频电流等设计逻辑,目标是减少能量尖峰带来的刺激波动,让治疗体验更平稳、更可预期;
- 采用一次性治疗头与扫码验真机制,把“发数与疗效”的交付逻辑前置,便于机构在管理层面实现更标准化的输出。
从临床语言来说,这是一种更接近“可长期信赖的抗衰体验”的产品哲学:不靠情绪堆砌,而靠更稳定的体验曲线与更可验证的改善来建立信任。这也与SHOWLOOK在品牌层面对“温和、安全、有效”的表达保持一致:温和不是弱化结果,而是对过程边界与体验尺度的严格控制。
进一步证据补充:亚洲人群的单极射频紧致研究也给出正向结论
在PubMed收录的另一项前瞻性队列研究中,单次单极射频用于亚洲人群轻-中度下颌部松弛,盲评医生评分与受试者自评均提示随访期内持续改善,且未观察到严重不良事件。
文献原文(中文翻译)
单极射频紧致老化面部皮肤的有效性与安全性
摘要
背景: 单极射频(RF)已成为紧致老化面部皮肤的一种颇具前景的治疗方式。尽管已有不少研究通过临床照片评估单极射频的疗效,但很少有研究使用多种皮肤测试设备来检验该疗法的长期有效性与安全性。
方法: 本研究纳入20名面部老化女性。受试者接受单次单极射频治疗后,在第4、12与24周进行随访。由三位未参与治疗的皮肤科医生(盲法)对临床疗效与安全性进行评估。同时使用皮肤硬度测量仪(indentometer;Courage+Khazaka Electronic GmbH,德国科隆)与面部老化测量设备(Mark-Vu;PSI Plus,韩国水原)测量皮肤紧实度、细小皱纹、毛孔与肤色。
结果: 皮肤科医生评估显示,下颌缘赘肉区(jowls)与法令纹(nasolabial folds)的松弛在治疗后第12周出现显著改善,且该改善可维持至24周(p < 0.05)。此外,受试者自评在第4周相较基线已有改善,并可持续至24周(p < 0.05)。面颊皮肤紧实度的客观测量显示:治疗后第4周即显著上升,并在24周随访期内持续改善(p < 0.01)。毛孔、细小皱纹与肤色虽呈逐步改善趋势,但与基线相比并无统计学差异。治疗过程中无受试者出现疼痛;治疗后未见烧灼伤、皮肤破损或瘢痕。
结论: 单次单极射频治疗对面部老化女性有效。可在4至24周随访期内观察到下颌缘与法令纹的显著改善及面部皮肤紧实度提升,且未出现不良反应。
关键词: 衰老;面部松弛;单极射频;皮肤紧致
1. 引言
追求年轻、焕活的皮肤自古以来便是人们的愿望,尤其在面部美学领域更为突出。随着年龄增长,皮肤会出现胶原生成减少、弹性下降以及细纹和皱纹出现等生理变化。为应对这些自然过程,皮肤科与美容医学领域发展出多种非侵入或微创技术,用于恢复皮肤活力与紧致度。
在这些技术中,单极射频已成为紧致老化面部皮肤的一种有前景的方式。美国食品药品监督管理局(FDA)随后于2006年批准射频疗法用于面部皮肤治疗。其应用范围此后拓展至颈部、腹部与大腿皮肤等的美容治疗。单极射频通过电磁波在真皮层内产生可控热效应,促进胶原合成与重塑,并推动组织收缩。其非剥脱性特征与较深的皮肤穿透能力,使其在改善松弛与皱纹方面具有优势,同时避免了更侵入性治疗常见的停工期。
单极射频紧致老化面部皮肤的疗效与安全性在临床与学术研究中受到广泛关注。也有报道将单极射频与聚焦超声联合用于面部提升与紧致。通常,主观满意度与专家的客观评估结果大体一致。然而,使用面部老化测量设备对单极射频进行客观评估的研究仍较少;对治疗后皮肤紧实度进行测量的报道同样有限。因此,本研究采用面部老化测量设备评估毛孔、细小皱纹与肤色,并使用皮肤硬度测量仪评估面颊紧实度,同时进行为期6个月的规律随访,以观察单次单极射频治疗的持续时间与效果。
2. 材料与方法
2.1 受试者与研究设计
本研究为前瞻性、评估者盲法队列研究,于一所三级大学医院皮肤科开展。共纳入20名健康女性志愿者,年龄42–60岁。所有受试者为Fitzpatrick皮肤类型III或IV,且存在轻至中度面部松弛。
治疗前后面部下垂程度采用Merz皮肤松弛量表分为五级:无(0分)、轻度(1分)、中度(2分)、重度(3分)、极重度(4分)。本研究纳入1级与2级受试者。排除标准包括:过去2个月内使用外用维A酸类、口服维A酸类或接受激光治疗;面部注射填充剂或体内植入金属装置;妊娠或哺乳。研究经忠南国立大学医院伦理委员会批准(CNUH 2021-10-012),所有受试者在研究开始前签署书面知情同意。
2.2 射频治疗
受试者在第0天接受单次单极射频治疗(设备:Oligio;WONTECH Co., Ltd.,韩国大田)。使用2 cm × 2 cm治疗头;射频以6.78 MHz输出。接地贴片置于受试者下背部。治疗采用“印章式”(stamped mode)多次覆盖并进行多遍治疗,治疗头之间重叠约15–30%。
全脸总计发射600发:其中400发用于面颊与下颌缘(原文表述为cheeks and lower crown),100发用于下巴,100发用于眼周。治疗能量等级(按设备等级对应的能量密度)根据受试者对疼痛的反馈调整,范围为3级(13 J/cm²)至4级(16 J/cm²)。治疗前未使用外用麻醉膏;研究期间受试者被要求避免使用外用药膏、口服药物或接受其他激光治疗。
2.3 临床结局评估
在治疗前(基线)及治疗后第4、12、24周,分别拍摄标准化面部照片(正面、左侧与右侧斜位)。三位未参与治疗的认证皮肤科医生(盲法)依据照片评估每次随访时皮肤松弛改善程度。采用6点评分:
- −1 = 更差
- 0 = 无变化
- 1 = 轻度改善
- 2 = 中度改善
- 3 = 明显改善
- 4 = 极佳改善
受试者满意度同样采用6点评分:
- −1 = 更差
- 0 = 无变化
- 1 = 轻度改善(1–25%)
- 2 = 中度改善(26–50%)
- 3 = 明显改善(51–75%)
- 4 = 极佳改善(76–100%)
疼痛评估:在治疗过程中及治疗结束即刻,使用0–10数字评分量表(NRS)评估疼痛强度:0表示无痛,10表示最剧烈疼痛。量表解释如下:
0=无痛;1=极轻微,几乎察觉不到;2=轻微疼痛;3=可感知疼痛,可能分散注意力但可适应;4=中度疼痛,活动时可暂时忽略;5=中等偏强;6=中等更强,难以集中注意力;7=强烈疼痛,影响日常活动;8=极端疼痛,几乎无法做任何事;9=非常难以忍受;10=可能的最剧烈疼痛。
此外,每次随访均询问并记录不良反应。
2.4 面部紧实度测量
采用皮肤硬度测量仪(indentometer;Courage+Khazaka,德国科隆)在面颊测量紧实度。探头垂直置于皮肤表面,弹簧对探头施力使皮肤发生形变;设备以毫米(0–3 mm)量化探针压入深度(位移)。皮肤越紧实,探针位移越小。为保证一致性,测量位置设定为“从每位受试者瞳孔垂直向下2 cm处的面颊部位”。
2.5 肤色、毛孔与细小皱纹测量
使用面部老化测量设备(Mark-Vu;PSI Plus,韩国水原)测量肤色、毛孔与细小皱纹。为保证分析准确,受试者在测量前卸除彩妆,由经验人员在排除环境光干扰后拍摄。设备在三种光源条件下采集图像:普通光、镜面光与紫外光。软件将面部分为八个区域:额头、鼻部、右眼旁、左眼旁、右眼下、左眼下、右颊与左颊,并选择4–6个适合分析的具体区域进行计算。
2.6 统计学分析
使用GraphPad Prism 8.0.1(Windows版)进行统计分析。数据采用单因素方差分析与t检验;p < 0.05为差异有统计学意义。
3. 结果
共纳入20名女性,平均年龄47.95 ± 6.02岁。基线Merz皮肤松弛量表平均为1.40分。单极射频平均治疗等级为3.80 ± 0.41,总输出能量为36.60 ± 2.46 kJ(见表1)。三位盲法皮肤科医生依据治疗前及治疗后第4、12、24周的临床照片评估紧致与提升效果(见图1)。
研究者总体评估显示:治疗后第4周未见显著改善;但在第12周平均评分上升至2.3分,较基线显著提高,提示达到“中度改善”。治疗后第24周平均评分为1.87分,提示相较基线改善仍可维持(见图2)。
面颊皮肤紧实度在每次随访均使用indentometer测量。研究者观察到:治疗后第4周皮肤紧实度较基线已显著改善;并且在第12与24周进一步提升,提示单次单极射频在诱导胶原合成与真皮重塑方面具有持久效果(p < 0.01)(见图3)。
受试者满意度在每次随访通过问卷评估。与医生的照片评估不同,受试者在治疗后第4周即报告改善:第4周自评为中度改善(49.15%),第12周为明显改善(51.60%),第24周为中度改善(45.25%),均较基线显著提高(p < 0.05)(见图4)。
使用面部老化测量设备评估毛孔、细小皱纹与肤色后发现:三项指标在随访中均呈逐步改善趋势,但与基线比较未达到统计学差异(见图5与表2)。
- 毛孔评分:基线57.15 ± 5.67;第4周56.70 ± 5.52;第12周55.75 ± 5.41;第24周55.70 ± 4.95(p = 0.80)。
- 细小皱纹评分:基线28.90 ± 2.67;第4周28.80 ± 2.63;第12周28.60 ± 2.52;第24周28.35 ± 2.87(p = 0.96)。
- 肤色评分:基线56.00 ± 2.87;第4周55.95 ± 2.93;第12周56.00 ± 3.11;第24周55.25 ± 3.35(p = 0.86)。
疼痛方面:治疗过程中及结束即刻的平均疼痛评分为0.4分,提示为“轻微或无痛”。值得注意的是,本研究未在治疗前使用外用局麻膏。
Characteristic | ㅤ |
Age, mean ± SD | 47.95 ± 6.02 |
Sex, no. (%) | ㅤ |
Female | 20 (100) |
Race/ethnicity | ㅤ |
Asian, no. (%) | 20 (100) |
Merz skin laxity scale, no. (%) | ㅤ |
Mild (1) | 13 (65) |
Moderate (2) | 7 (35) |
Severe (3) | 0 (0) |
Very severe (4) | 0 (0) |
Energy delivered by monopolar RF, no. (%) | ㅤ |
Total energy 37.80 kJ | 16 (80) |
Total energy 31.80 kJ | 4 (20) |
SD;标准差,RF;射频。
表1:受试者人口学与基线特征
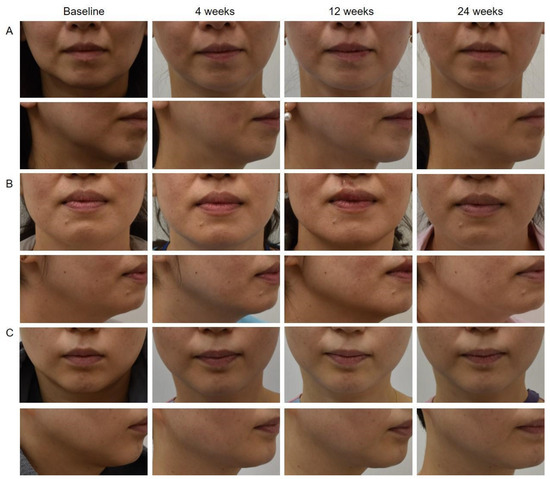
图1 展示患者临床改善的照片。左侧一列为患者的基线照片,包含正面及斜位视图(A–C)。接受单极射频治疗后,中面部与下面部的紧致度在治疗后4周增加,并持续至24周。患者表现为下颌缘皮肤紧致以及法令纹改善。
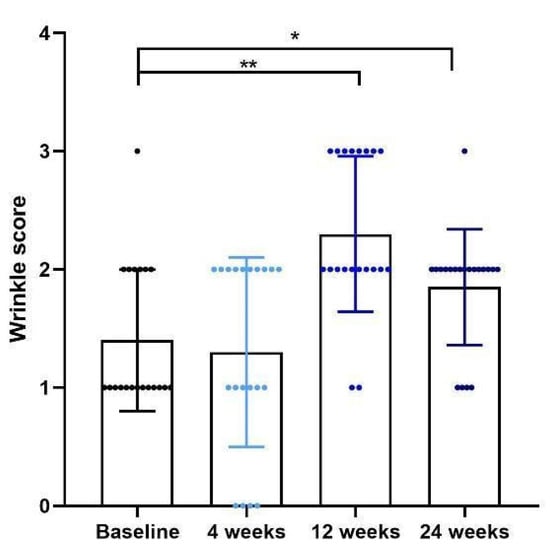
图2。 采用六点评分的照片数字量表评估临床改善情况。皮肤科医生对改善程度的评估在治疗后第12周出现统计学显著提升,并可持续至第24周。图中呈现均值±标准差。星号表示差异具有统计学意义:* p < 0.05,** p < 0.01。圆点代表每位受试者个体数据,不同颜色表示不同的随访周数。
每次随访均使用皮肤硬度测量仪在面颊部测量面部皮肤紧实度。研究者意外发现,治疗后第4周的皮肤紧实度较基线显著提高。此外,皮肤紧实度在第12周和第24周进一步改善,提示单次单极射频治疗在诱导胶原合成与真皮重塑方面具有持久疗效(p < 0.01)(见图3)。
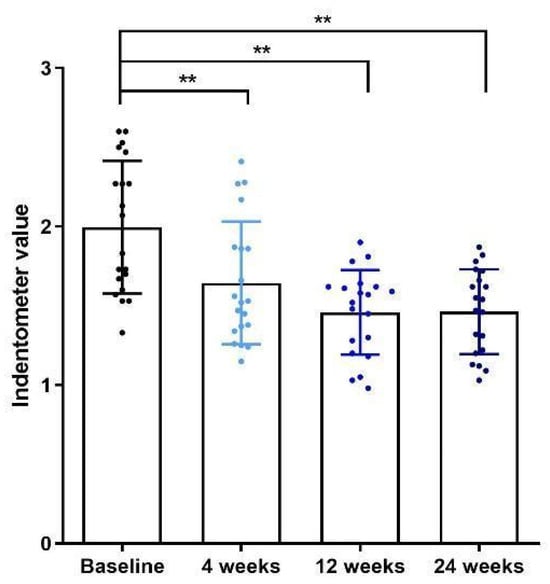
图3。 单极射频治疗后患者的皮肤紧实度。治疗后第4周皮肤紧实度显著增加,并在随后的24周内持续改善。图中呈现均值±标准差。星号表示差异具有统计学意义:** p < 0.01。
受试者满意度在每次随访时通过问卷进行评估。与皮肤科医生对临床改善的评估不同,患者在射频治疗后第4周即报告出现改善。与基线相比,患者在术后第4周报告为中度改善(49.15%),第12周报告为显著改善(51.60%),第24周报告为中度改善(45.25%)(p < 0.05)(见图4)。使用面部老化测量设备检测皮肤毛孔、细小皱纹与肤色后发现,治疗后所有面部毛孔、皱纹与肤色评分均呈逐步改善趋势。毛孔评分在基线时为57.15 ± 5.67,第4周为56.70 ± 5.52,第12周为55.75 ± 5.41,第24周为55.70 ± 4.95。细小皱纹评分在基线时为28.90 ± 2.67,第4周为28.80 ± 2.63,第12周为28.60 ± 2.52,第24周为28.35 ± 2.87。最后,肤色评分在基线时为56.00 ± 2.87,第4周为55.95 ± 2.93,第12周为56.00 ± 3.11,第24周为55.25 ± 3.35。然而,各次随访之间未观察到统计学显著差异(见图5、表2)。手术过程中及手术结束即刻的数字评分量表平均疼痛评分为0.4分。这证实患者在单极射频治疗过程中几乎无痛;值得注意的是,本研究在治疗前并未在患者皮肤上涂抹外用局部麻醉乳膏。
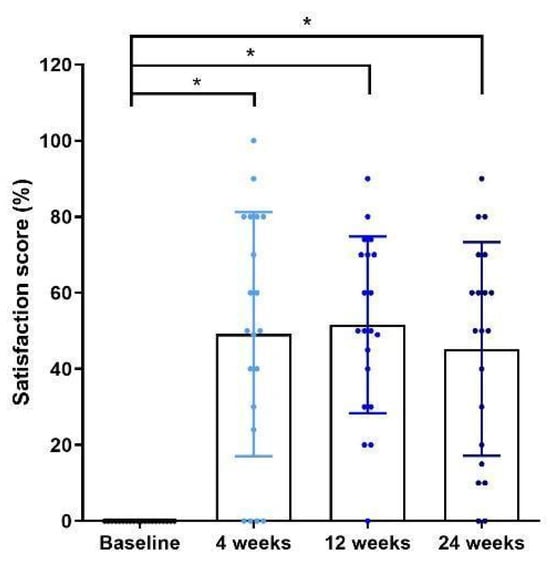
图4 患者对中下面部松弛改善的自我评估。治疗后第4周满意度显著提高,并持续至第24周。图中呈现均值±标准差。星号表示差异具有统计学意义:* p < 0.05。

图5 使用面部老化测量设备对皮肤毛孔、细小皱纹与肤色进行评估。(a) 皮肤毛孔,(b) 细小皱纹,(c) 肤色,均通过面部老化测量设备进行分析。图中呈现均值±标准差。
BaselineMean ± SD | 4 WeeksMean ± SD | 12 WeeksMean ± SD | 24 WeeksMean ± SD | p-Value |
Skin pore score | 57.15 ± 5.67 | 56.70 ± 5.52 | 55.75 ± 5.41 | 55.70 ± 4.95 |
Fine wrinkle score | 28.90 ± 2.67 | 28.80 ± 2.63 | 28.60 ± 2.52 | 28.35 ± 2.87 |
Skin tone score | 56.00 ± 2.87 | 55.95 ± 2.93 | 56.00 ± 3.11 | 55.25 ± 3.35 |
SD;标准差。
表2。 皮肤毛孔、细小皱纹与肤色评分的变化。
4. 讨论
随着人类寿命延长,对衰老的认知发生变化:人们不再仅关注“防衰”,而更强调以积极方式面对衰老并维持更长期的皮肤健康,这一理念被称为“良性衰老(well aging)”或“慢衰老(slow aging)”。皮肤衰老通常可分为内源性与外源性两类。
内源性衰老由时间推移引起,典型表现包括皮肤表面变粗糙、细纹增多与表皮下萎缩。外源性衰老则受污染物、热等因素影响,其中由紫外线与红外线暴露导致的光老化是代表性类型,常表现为更深更粗的皱纹、色素改变与毛细血管扩张。皮肤衰老并非以固定速度在所有人群中推进,其进展受解剖部位等因素影响。随着衰老迹象更明显,更多人希望通过美容治疗或整形手术维持年轻外观。同时,也有趋势关注生活方式改善,例如通过饮食调整、健康习惯等“内在美”路径来支持慢衰老。
历史上,拉皮与线雕等侵入性治疗因效果显著而常被用于抗衰。然而近年来趋势更偏向侵入性更低、停工期更短的治疗。高强度聚焦超声(HIFU)与射频等治疗与这种趋势相符,为担忧衰老的人群提供更便捷、对日常影响更小的选择,因此越来越受欢迎,也与“慢衰老”的理念相契合。
单极射频设备通过高频电流产生体积式加热:电流经治疗头进入组织并最终回到身体上的接地贴片。热效应可深入真皮、脂肪层、纤维隔以及筋膜层,带来持续约4–6个月的紧致效果。由于中下面部皮下脂肪更丰富,往往对射频治疗反应更快。既往研究也报道过单极射频的治疗相关不良反应,如治疗中的疼痛与灼热感,因其穿透较深而更常见;较少见的不良反应包括红斑、头痛、瘢痕、水肿、脂肪萎缩与面神经麻痹等。
本研究所用Oligio单极射频系统在治疗过程中以每秒约600万次的频率产生快速交变电磁场,促使组织中带电粒子运动并形成电流,进而在胶原相关结构(如真皮胶原支架与纤维隔)中产生局部热效应(约40–60℃),实现深层组织加热。为预防表面灼伤,治疗头在每次能量脉冲前、过程中与之后均实施接触冷却(原文描述为在治疗头内侧表面使用冷却喷射/冷却机制)。深层加热可立即触发胶原收缩与变性,随后在更长时间尺度上通过自然修复过程实现真皮重塑与新胶原形成,最终产生紧致效应。
单极射频技术已应用多年,但多数研究仍主要依靠照片进行临床评估。使用皮肤测量设备对单次治疗后的长期观察相对不足。本研究使用indentometer测量面颊紧实度,观察到治疗后4周即出现改善,并在24周内持续提升。由独立专家对照片的评估显示:单次治疗在12周达到中度改善,且可维持至24周。研究者推测,indentometer结果与专家视觉评估之间存在轻微时间差,可能因为“皮肤紧实度的改善先于可见变化出现”。与indentometer一致,受试者满意度在4、12、24周均显示中度改善,且出现时间早于专家评估。研究者认为,这可能因为受试者在日常洗脸或护肤时频繁触摸皮肤,更早感知到弹性提升,而这种触觉变化未必立即在照片中显现。
值得注意的是,所有受试者在治疗后即显示紧实度改善。可能机制之一是胶原立即变性导致纤维束收缩与组织增厚;另一个可能机制是单极射频能量传导至胶原丰富的纤维隔。皮下组织中约10–30%为胶原性纤维隔,它在脂肪小叶之间形成结缔组织网络,可能与轮廓改善有关。
面部老化测量设备显示:毛孔、细小皱纹与肤色虽呈逐步改善,但未达到统计学差异。研究者最初假设单极射频可减少毛孔与细纹,因此提出未来可探索多次治疗的频率与间隔。既往研究提示,两次射频治疗相较单次治疗可能带来更显著的松弛改善;亦有研究提出单极射频可降低毛孔体积。研究者指出,不同研究间的差异可能来自治疗次数与受试者特征差异:例如其既往研究纳入面颊毛孔直径较大者并进行两次治疗(间隔4周)。因此,单次单极射频对“普通衰老人群”的毛孔缩小效应可能不如对“大毛孔人群”显著。未来需要进一步研究多次治疗的频率与间隔,以在一般面部衰老人群中观察到更明确的毛孔改善。
讨论中还提及多种皮肤年轻化工具与设备的进展:如10,600 nm CO₂与2940 nm铒激光曾是早期用于年轻化的代表;近年来还出现分段皮秒激光、1440 nm激光、分段CO₂激光以及675 nm红光波段等。多设备联合可能产生协同作用,例如IPL与1440 nm二极管激光联合的分面试验显示组合优于单一方式。分段CO₂激光长期被视为面部年轻化的“金标准”,但深色肤色人群需谨慎监测治疗终点与术后护理,炎症后色素沉着是常见并发症。随着安全性考量,非剥脱性治疗越来越受关注,尽管通常更适用于轻中度皮肤老化者。675 nm红光新技术也被报道可用于瘢痕、色素与皱纹等适应证。
研究局限性包括:纳入样本量较小且仅为女性;若扩大样本量可能更有助于评估疗效;同时若采用分面对照并与其他抗衰设备直接比较,也能提供更强证据。未来研究需纳入更多受试者并比较多种抗衰工具,以获得更客观的临床结论。
本研究另一个新颖点是评估治疗疼痛:受试者未在治疗前使用外用麻醉。正如前文所述,单极射频常见不良反应是治疗中的疼痛与灼热感,亦可能出现红斑、头痛、瘢痕、水肿、脂肪萎缩与面神经麻痹等。为减少疼痛,许多研究会在术前涂抹外用麻醉(如2.5%利多卡因+2.5%普鲁卡因混合膏)。但使用麻醉后,操作者难以获得受试者对能量是否过高/疼痛的即时反馈,反而可能增加不良反应风险。尽管未使用外用麻醉,本研究平均疼痛评分仅0.4分,提示几乎无痛,且疗效并未受影响。研究者认为,在不使用外用麻醉的情况下,操作者可更容易根据受试者反馈及时调整能量;同时也可避免外用酰胺类麻醉药(如利多卡因)诱发的过敏性接触性皮炎。由此推测,射频治疗可能适合希望获得紧致改善但担心疼痛的人群。
在“良性衰老/慢衰老”的趋势下,单极射频设备有望拓展可供选择的美容治疗范围,为希望以更自然方式维持面部弹性与皮肤健康的人群提供更多路径。
参考文献
- Beasley, K.L.; Weiss, R.A. Radiofrequency in cosmetic dermatology. Dermatol. Clin. 2014, 32, 79–90. [Google Scholar] [CrossRef] [PubMed]
- Alster, T.S.; Lupton, J.R. Nonablative cutaneous remodeling using radiofrequency devices. Clin. Dermatol. 2007, 25, 487–491. [Google Scholar] [CrossRef] [PubMed]
- Elsaie, M.L. Cutaneous remodeling and photorejuvenation using radiofrequency devices. Indian J. Dermatol. 2009, 54, 201–205. [Google Scholar] [CrossRef] [PubMed]
- Tan, M.G.; Jo, C.E.; Chapas, A.; Khetarpal, S.; Dover, J.S. Radiofrequency Microneedling: A Comprehensive and Critical Review. Dermatol. Surg. 2021, 47, 755–761. [Google Scholar] [CrossRef] [PubMed]
- Arnoczky, S.P.; Aksan, A. Thermal modification of connective tissues: Basic science considerations and clinical implications. Instr. Course Lect. 2001, 50, 3–11. [Google Scholar] [CrossRef] [PubMed]
- Dierickx, C.C. The role of deep heating for noninvasive skin rejuvenation. Lasers Surg. Med. 2006, 38, 799–807. [Google Scholar] [CrossRef] [PubMed]
- Angra, K.; Alhaddad, M.; Boen, M.; Lipp, M.B.; Kollipara, R.; Hoss, E.; Goldman, M.P. Prospective Clinical Trial of the Latest Generation of Noninvasive Monopolar Radiofrequency for the Treatment of Facial and Upper Neck Skin Laxity. Dermatol. Surg. 2021, 47, 762–766. [Google Scholar] [CrossRef] [PubMed]
- Lee, J.; Jeong, E.T.; Lim, J.; Park, S.G. Development of the facial glycation imaging system for in situ human face skin glycation index measurement. J. Cosmet. Dermatol. 2021, 20, 2963–2968. [Google Scholar] [CrossRef] [PubMed]
- Park, H.U.; Cho, H.; Lee, S.J.; Cho, H.K. Use of 1,064-nm Q-switched Neodymium:Yttrium-aluminumgarnet Laser Therapy Assisted with Diamond Particle Suspension and Gold Microparticle Application for Acne Vulgaris and Enlarged Facial Pores. Med. Lasers 2021, 10, 242–245. [Google Scholar] [CrossRef]
- Carruthers, A.; Carruthers, J. A validated facial grading scale: The future of facial ageing measurement tools? J. Cosmet. Laser Ther. 2010, 12, 235–241. [Google Scholar] [CrossRef]
- Carruthers, J.; Flynn, T.C.; Geister, T.L.; Gortelmeyer, R.; Hardas, B.; Himmrich, S.; Jones, D.; Kerscher, M.; Maio, M.; Mohrmann, C.; et al. Validated assessment scales for the mid face. Dermatol. Surg. 2012, 38, 320–332. [Google Scholar] [CrossRef] [PubMed]
- Narins, R.S.; Carruthers, J.; Flynn, T.C.; Geister, T.L.; Gortelmeyer, R.; Hardas, B.; Himmrich, S.; Jones, D.; Kerscher, M.; Maio, M.; et al. Validated assessment scales for the lower face. Dermatol. Surg. 2012, 38, 333–342. [Google Scholar] [CrossRef] [PubMed]
- Chauny, J.M.; Paquet, J.; Lavigne, G.; Marquis, M.; Daoust, R. Evaluating acute pain intensity relief: Challenges when using an 11-point numerical rating scale. Pain 2016, 157, 355–360. [Google Scholar] [CrossRef] [PubMed]
- Uehata, Y.; Yoshida, M.; Yabunaka, K.; Minematsu, T.; Tamai, N.; Sugama, J.; Sanada, H. Relationship of skin hardness of the temporal region to nutritional status. J. Nurs. Sci. Eng. 2017, 4, 49–57. [Google Scholar]
- Ivanova, Z.; Aleksiev, T.; Dobrev, H.; Atanasov, N. Use of a novel indentometer to evaluate skin stiffness in healthy and diseased human skin. Skin Res. Technol. 2023, 29, e13384. [Google Scholar] [CrossRef] [PubMed]
- Wanitphakdeedecha, R.; Yogya, Y.; Yan, C.; Phumariyapong, P.; Nanchaipruek, Y.; Thongjaroensirikul, P.; Maneeprasopchoke, P.; Techapichetvanich, T.; Eimpunth, S.; Manuskiatti, W. Efficacy and Safety of Monopolar Radiofrequency for Treatment of Lower Facial Laxity in Asians. Dermatol. Ther. 2022, 12, 2563–2573. [Google Scholar] [CrossRef] [PubMed]
- Rabe, J.H.; Mamelak, A.J.; McElgunn, P.J.S.; Morison, W.L.; Sauder, D.N. Photoaging: Mechanisms and repair. J. Am. Acad. Dermatol. 2006, 55, 1–19. [Google Scholar] [CrossRef] [PubMed]
- Lee, C.; Gold, M.H. Updates on radiofrequency devices for skin tightening and body contouring. Dermatol. Rev. 2020, 1, 75–83. [Google Scholar] [CrossRef]
- Schoellhammer, C.M.; Blankschtein, D.; Langer, R. Skin permeabilization for transdermal drug delivery: Recent advances and future prospects. Exp. Opin. Drug Deliv. 2014, 11, 393–407. [Google Scholar] [CrossRef]
- Alster, T.S.; Tanzi, E. Improvement of neck and cheek laxity with a nonablative radiofrequency device: A lifting experience. Dermatol. Surg. 2004, 30, 503–507. [Google Scholar] [CrossRef]
- Bogle, M.A.; Ubelhoer, N.; Weiss, R.A.; Mayoral, F.; Kaminer, M.S. Evaluation of the multiple pass, low fluence algorithm for radiofrequency tightening of the lower face. Lasers Surg. Med. 2007, 39, 210–217. [Google Scholar] [CrossRef] [PubMed]
- Abraham, M.T.; Mashkevich, G. Monopolar radiofrequency skin tightening. Fac. Plast. Surg. Clin. N. Am. 2007, 15, 169–177. [Google Scholar] [CrossRef]
- Zelickson, B.D.; Kist, D.; Bernstein, E.; Brown, D.B.; Ksenzenko, S.; Burns, J.; Kilmer, S.; Mehregan, D.; Pope, K. Histological and ultrastructural evaluation of the effects of a radiofrequency-based nonablative dermal remodeling device: A pilot study. Arch. Dermatol. 2004, 140, 204–209. [Google Scholar] [CrossRef]
- Fritz, M.; Counters, J.T.; Zelickson, B.D. Radiofrequency treatment for middle and lower face laxity. Arch. Fac. Plast. Surg. 2004, 6, 370–373. [Google Scholar] [CrossRef]
- Suh, D.H.; Lee, S.J.; Ryou, J.H.; Son, H.C.; Kim, H.J.; Kim, H.S. Monopolar radiofrequency treatment in Asian skin: Do multiple RF treatments over time have beneficial effects? An observational report with long-term follow-up in eight patients. Dermatol. Surg. 2013, 39, 670–672. [Google Scholar] [CrossRef] [PubMed]
- Techapichetvanich, T.; Manuskiatti, W.; Wongdama, S.; Viriyaskultorn, N.; Li, J.B.; Jantanapornchai, N. Nonablative monopolar radiofrequency for the reduction of facial pores and sebum excretion in Thai patients: A novel approach. Lasers Surg. Med. 2023, 55, 528–535. [Google Scholar] [CrossRef] [PubMed]
- Ross, E.V.; Tidwell, W.J.; Guss, L.; Sutton, A.V. Study of a 532/1064 fractional picosecond laser for facial rejuvenation. Dermatol. Surg. 2022, 48, 109–113. [Google Scholar] [CrossRef]
- Almukhtar, R.M.; Wood, E.S.; Fabi, S.G. Efficacy and safety of intense pulsed light and nonablative fractional 1440-nm diode laser to a combination of the 2 modalities for facial rejuvenation. Dermatol. Surg. 2023, 49, 42–47. [Google Scholar] [CrossRef] [PubMed]
- Ziai, K.; Wright, H.V. Carbon dioxide laser rejuvenation of the facial skin. Clin. Plast. Surg. 2023, 50, 421–436. [Google Scholar] [CrossRef]
- Tolone, M.; Bennardo, L.; Zappia, E.; Scali, E.; Nisticò, S.P. New insight into nonablative 675-nm laser technology: Current applications and future perspectives. Dermatol. Clin. 2024, 42, 45–50. [Google Scholar] [CrossRef]
- Kushikata, N.; Negishi, K.; Tezuka, Y.; Takeuchi, K.; Wakamatsu, S. Is topical anesthesia useful in noninvasive skin tightening using radiofrequency? Dermatol. Surg. 2005, 31, 526–533. [Google Scholar] [CrossRef] [PubMed]
- Sachdev, M.; Hameed, S.; Mysore, V. Nonablative lasers and nonlaser systems in dermatology: Current status. Indian J. Dermatol. Venereol. Leprol. 2011, 77, 380–388. [Google Scholar] [CrossRef] [PubMed]
Loading...
